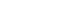在传统临床实践中,获得肿瘤患者组织样本只有手术活检和穿刺活检两种。转移期肿瘤患者体内可能有多个肿瘤病灶,具体到从哪个病灶获取肿瘤组织样本是一大问题。
肿瘤患者血液中存在少量循环肿瘤细胞以及由坏死癌细胞释放的少量循环肿瘤 DNA。通过检测血液中的循环肿瘤细胞(CTC,circulating tumor cell)和循环肿瘤DNA(ctDNA,circulating tumor DNA)对患者肿瘤进行诊断与监测的方法被称为液体活检。相比于传统的活检方法,液体活检具有副作用小、操作简单、能重复取样等优点。
CTC概述
CTC的富集与检测
人体循环系统中CTC的含量极低,肿瘤转移患者每毫升全血中仅有1~10 个CTC,因此要实现CTC的检测对其进行分选富集是一个必不可少的步骤。CTC分选富集效果的优劣将会直接影响其后续的检测(计数、基因扩增、基因测序等)效果,因此高纯度、高灵敏性(不丢失CTC)、快速、高细胞活性的CTC分选富集是CTC临床应用的重点和难点。
CTC 的富集方法可以分为免疫亲和富集法和物理特性富集法。免疫亲和法主要是根据细胞表面表达的特异性的蛋白将CTC筛选出来,物理特性富集主要是根据CTC 的大小和密度等特性将这些细胞筛选出来。微流控芯片技术凭借多种优势已经在CTC富集分选中得到越来越广泛的应用,有望在将来成为CTC富集和检测工具之一。
利用免疫亲和或物理特性法可富集到CTC,接下来还需要结合有效的下游分析方法。一方面,由于目前CTC捕获技术不能保证百分之百的纯度,需要对所得到的细胞进行鉴定,以进一步确定CTC细胞的数目,以减少CTC数目判定的假阳性率和假阴性率。另一方面,在肿瘤的发生发展过程中,不仅CTC的数目在动态的变化,CTC所携带的分子标志物也在变化,通过对CTC表面标志物检测,能够反应肿瘤发生发展的动态变化,是研究肿瘤发生发展机制的有效策略,并能很好地指导临床治疗。
循环肿瘤细胞(CTC)是指从实体肿瘤原发灶或转移灶脱落而进入外周血循环的肿瘤细胞,是肿瘤复发转移的关键细胞。在肿瘤发展的任何阶段,都可能有肿瘤细胞脱落进入外周血而形成CTC,CTC数量的变化可以实时反应肿瘤的疾病进展状态。实验证实,当肿瘤1-2mm大、影像学等传统手段无法检测出时,血液中已可检出CTC。
Credit: H. McDonald/Science Translational Medicine
最新研究证实,除了从已形成的实体瘤病灶(原发灶、转移灶)脱落进入血液外,肿瘤细胞在形成实体瘤病灶之前便有可能进入血液系统中,由此提示循环肿瘤细胞的存在往往要早于影像学或临床症状的表现。
近几年CTC检测在肿瘤辅助诊断、监控等方面的临床表现逐渐崭露头角,是目前最具发展潜力的肿瘤无创诊断和实时监测手段之一。大量实验已经证实CTC检测有助于肿瘤的早期诊断、预后评估、疗效监测及个体化治疗方案制定等。
redit:Catherine Alix-Panabieres et al. Clinical Chemistry.
2013;59(1):110-118.
表1:CTC检测与常规检测的对比
|
肿瘤诊断方法 |
优点 |
缺点 |
|
影像学 |
①较快速
|
①特异性不足 ②对病灶大小有要求 ③结果普遍存在滞后性 ④射线对身体有损伤 |
|
病理学 |
①诊断金标准
|
①取样会带来创伤和扩散风险 ②很多早期患者无法取样或取样不足。 |
|
血清标志物 |
①自动化检测,费用低廉 ②适用于大众筛查 ③可为影像学提供参考数据 |
①有些肿瘤没有特异性的血清学标志物 ②假阳性 ③特异性不足 |
|
循环肿瘤细胞(CTC)检测 |
①非侵入性 ②可定性和定量 ③高敏感性、高特异性 ④好的肿瘤转移指标 ⑤可实时动态监测 ⑥检测诊断窗口提前 |
检测费用较高 |
CTC--肿瘤标志物
2007年ASCO将CTC纳入肿瘤标志物。
CTC的临床应用被国内外众多指南和共识推荐
循环肿瘤细胞(CTC)的特性
1. 稀有性:
每10mL血液中可能仅含有几个到几十个循环肿瘤细胞。
2. 非典型性的细胞形态:
一般比血液细胞,正常组织细胞体积大;细胞核大,不规则,细胞核质比高;不易发生变形。
3. 异质性:
细胞表面抗原标志物表达差异,携带不同的分子信息,转移潜力差异。
4. 不同类别:
CTC可以是间质型、上皮型或者上皮间质混合型,CTC也既可以是单个细胞的CTC也可以是成团的CTCs(CTM)。
常用的CTC检测技术:免疫荧光、PCR、FISH及高通量测序等。
1. 免疫荧光法(IF):
实体肿瘤细胞一般均为上皮来源,细胞内会表达角蛋(cytokeratin, CK)或其他肿瘤标示物(如HER2)。借助免疫荧光染色,可对来自实体瘤CTC中的瘤标进行识别,从而达到检测CTC的目的。这也是目前检测CTC的最常见方法。缺点是,在CTC形成过程的间质化(EMT)阶段,大量的CK会降解,从而在CTC检测过程中出现假阴性。
2. 荧光原位杂交(FISH):
荧光原位杂交,是根据已知细胞内特异的DNA序列,以利用荧光标记的特异寡聚核苷酸片段作为探针,与细胞内的基因组中DNA分子杂交,检测该特异基因序列的存在与丰度。FISH技术与CTC结合,不仅可以检测CTC表面标志物,也可以检测CTC细胞内部的标志物及核型等。
3. RT-PCR,反转录PCR:
提取组织或细胞中的总RNA,以其中的mRNA作为模板,采用引物和逆转录酶将mRNA反转录成cDNA。再以cDNA为模板进行PCR扩增,而获得目的基因或检测基因表达。RT-PCR使RNA检测的灵敏性提高了几个数量级,使一些极为微量RNA样品分析成为可能。结合RT-PCR可同时对若干个基因的表达进行检测。位点特异性PCR技术可用于检测CTC携带的驱动基因的突变情况。
4. 二代测序 (NGS):
CTC数量少,直接进行二代测序难度大。需要将单细胞的DNA扩增后,再利用二代测序检查基因序列。但是,目前单细胞测序的技术仅仅停留在实验室阶段,未来向市场推广还有很长的路要走。而且由于肿瘤细胞的异质性,单细胞测序是否有代表性还需要更多的科学研究来证明。
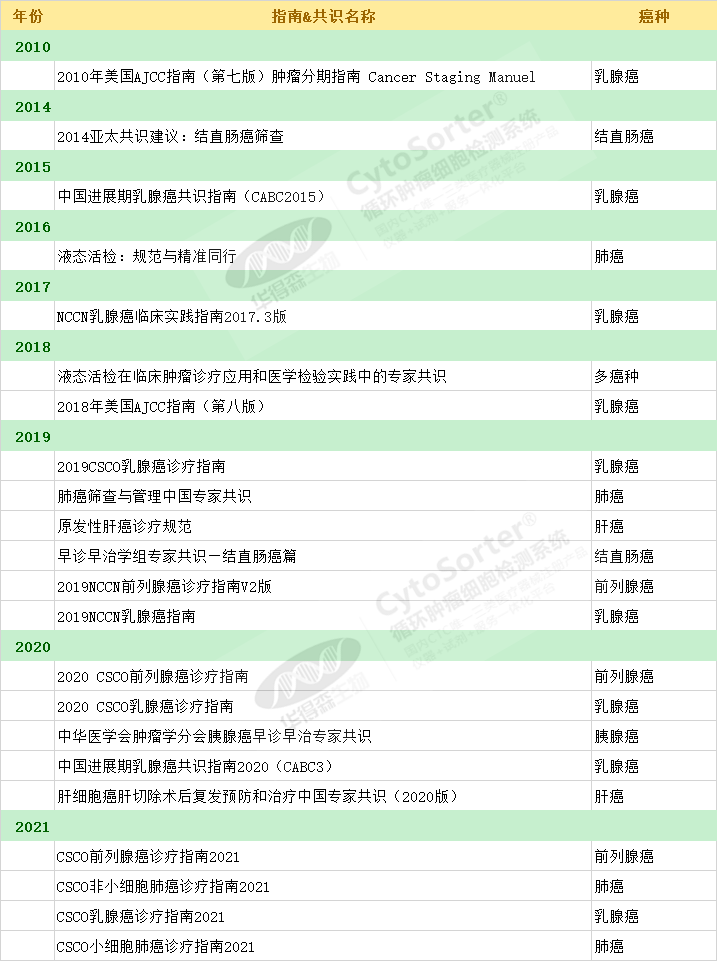
表2. CTC临床指南与共识
CTC学院
实时“液体活检”,助力“精准医疗”