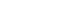CTC检测在结直肠癌临床诊疗中的应用
(1)CTC检测辅助结直肠癌辅助诊断

病例分析: 患者 女 65岁 (疑似结直肠癌)
2017年5月3日,内镜:结肠息肉。
2017年5月4日,内镜取黏膜,病理诊断,上皮内瘤变。
2017年5月10日,7.5ml外周血,CSV 捕获CTC,11颗。
2017年5月17日,外科手术切除,组织病理检测,肠癌Ⅱ期。
- 通过实验室检查(内镜),无法确诊;外周血CTC 检测,可进行肿瘤辅助诊断。
注:本应用数据来源于杭州华得森生物实验室检验临床案例
(2)CTC检测辅助结直肠癌预后评估
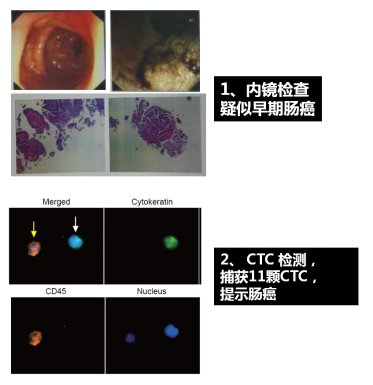
2008年美国食品药品监督管理局(FDA)审批CTC检测可以用于转移性结直肠癌预后评估,预测患者生存期。
当CTC数量≥3时,患者的预后较差,生存期较短;
当CTC数量<3时,患者的预后较好,生存期较长。
Cohen SJ, Punt CJA, Iannotti N, et al. Relationship of circulating tumor cells to tumor response, progression-free survival, and overall survival in patients with metastatic colorectal cancer. J Clin Oncol. 2008;26(19):3213-3221.
预后评估符合精准医疗的精髓,可以辅助医生对患者进行精准分类,对预后较差的患者,给予重点关注,及时变更治疗方案,提高患者的生存质量,延长患者的生存期,减少患者的经济压力。
- 287名具有潜在可治愈非转移CRC患者。包括239名UICC I-III期的患者。术前和术后第3天、第7天外周血检测CTC。完全对照组(UICC I-IV)和非转移组(UICC I-III)被独立分析。对患者进行了28(0-53)个月的随访。使用单变量和多变量分析分析总体和无进展存活的预后因素。
- 转移性CRC患者中更频繁地检测到CTC。
- 当CTC≥1时,提示非转移CRC组(UICC I-III) (49.8 vs 38.4个月; P <0.001)与完整对照组(48.4 vs 33.6个月; P <0.001)具有较差的总生存期。
- 在多变量分析中,CTC是非转移性患者以及整个研究组中最强的预后因素。
- 术前CTC检测是非转移性CRC的强有力且独立的预后标志物。
Bork U, Rahbari NN, et al. Circulating tumour cells and outcome in non-metastatic colorectal cancer: a prospective study. Br J Cancer. 2015 Apr 14;112(8):1306-13.
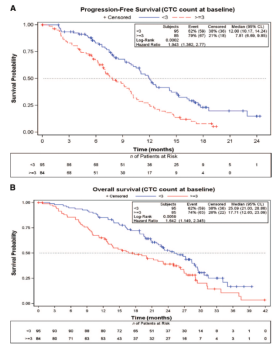

- 转移性结肠直肠癌维持试验III期研究,评估单药贝伐单抗与贝伐单抗联合化疗对转移性结直肠癌患者的维持治疗疗效。480名患者。在基线和三个疗程后进行CTC计数检测。在第3和第6周期以及之后每12周进行CT检测评估肿瘤治疗效果。
- 基线CTC计数≥3的患者中位无进展生存期(PFS)为7.8个月,而CTC计数<3的患者为12.0个月(p =0.0002) 。 CTC计数≥3的患者的中位总生存期(OS)时间为17.7个月,而CTC计数较低的患者为25.1个月(p =0.0059)。三个疗程后,CTC计数低的患者的中位PFS为10.8个月,显著长于CTC计数高的患者的7.5个月(p = 0.005)。 CTC计数<3的患者的中位OS时间显着长于CTC计数≥3的患者,25.1个月与16.2个月(p = 0.0095)。
- CTC计数是转移性结直肠癌患者PFS和OS的强预后因子。
Sastre J, Maestro ML, et al. Circulating tumor cell count is a prognostic factor in metastatic colorectal cancer patients receiving first-line chemotherapy plus bevacizumab: a Spanish Cooperative Group for the Treatment of Digestive Tumors study. Oncologist. 2012;17(7):947-55
(3)CTC检测辅助结直肠癌疗效监测
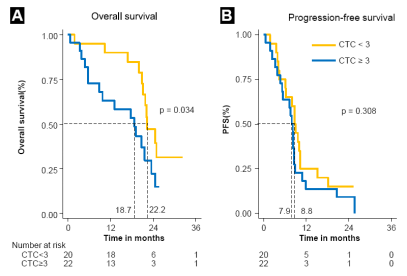
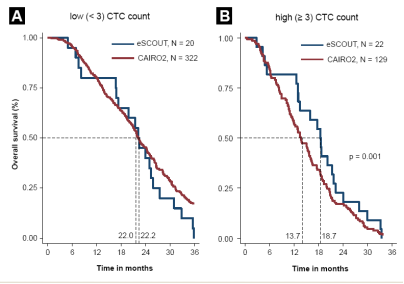
- 使用伊立替康,奥沙利铂和替加氟-尿嘧啶与甲酰四氢叶酸,西妥昔单抗的方案,对先前未治疗的KRAS野生型晚期结直肠癌(ACRC)患者进行单臂II期I试验(爱必妥研究CPT11,奥沙利铂,氟尿嘧啶靶向治疗[eSCOUT])。
- 48名符合条件的患者,4种药物治疗方案的最佳客观反应率(ORR为71%,疾病控制率为98%。CTC计数高(≥3)和低(<3)的患者的中位OS分别为18.7和22.3个月(P=0.038)。
- 对于ACRC患者,CTC计数分层可以识别那些可能从强化的四药方案中获益最多的人,避免低CTC组的高毒性方案。
Krebs MG, Renehan AG, et al. Circulating Tumor Cell Enumeration in a Phase II Trial of a Four-Drug Regimen in Advanced Colorectal Cancer. Clin Colorectal Cancer. 2015 Jun;14(2):115-22.e1-2
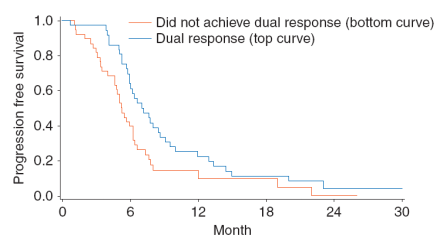

- 接受一线化疗治疗转移性结直肠癌的患者中,符合条件的84名患者在基线和开始化疗后4-6周进行PET-CT和CTC分析,然后在10-12周进行CT扫描以评估实体瘤反应评估标准(RECIST)反应。
- 当CTC≥3时,接受一线化疗治疗转移性结直肠癌的患者化疗治疗效果不佳,当CTC<3时,接受一线化疗治疗转移性结直肠癌的患者化疗治疗效果良好。
- CTC在转移性结直肠癌接受一线化疗的患者中具有早期预测药物反应的价值。CTC数目变化可在早期(开始化疗后4~6周)预测肿瘤治疗的客观反应率。与现行影像学检查评价体系(实体瘤疗效评价标准,于治疗后10~12周评价)比较,CTC早期疗效预测的灵敏度、特异度和阳性预测值分别为64%、70%和74%。
- CTC可作为转移性结直肠癌的早期疗效预测工具。
Ma B, King AD, et al. Identifying an early indicator of drug efficacy in patients with metastatic colorectal cancer-a prospective evaluation of circulating tumor cells, 18F-fluorodeoxyglucose positron-emission tomography and the RECIST criteria. Ann Oncol. 2017 Jul 1;28(7):1576-1581.
(4)CTC检测辅助结直肠癌复发监测
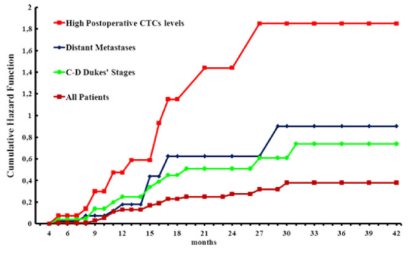
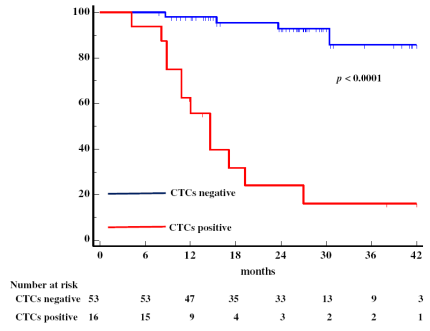
- 术后高循环肿瘤细胞水平能够准确预测肿瘤复发,CTC的评估可以优化结肠直肠癌患者的个体化管理。
Galizia G, Gemei M, et al. Postoperative detection of circulating tumor cells predicts tumor recurrence in colorectal cancer patients. J Gastrointest Surg. 2013 Oct;17(10):1809-18.

- 90例III期结肠癌患者检测CTC,这些患者接受根治性切除,然后进行mFOLFOX化疗。
- 化疗后持续存在CTC是化疗后复发的独立预测因子。
- 化疗后CTC的持续存在比化疗后CEA水平,更准确预测化疗后III期结肠癌患者复发(优势比:50.091 vs 5.211)。
- 化学治疗后CTC持续存在是用于确定接受辅助mFOLFOX化学疗法的III期结肠癌患者的临床结果的潜在强有力的替代标志物。
Lu CY, Tsai HL, et al. Circulating tumor cells as a surrogate marker for determining clinical outcome to mFOLFOX chemotherapy in patients with stage III colon cancer. Br J Cancer. 2013 Mar 5;108(4):791-7
(5)CTC动态监测辅助结直肠癌疗效评估与预后评估
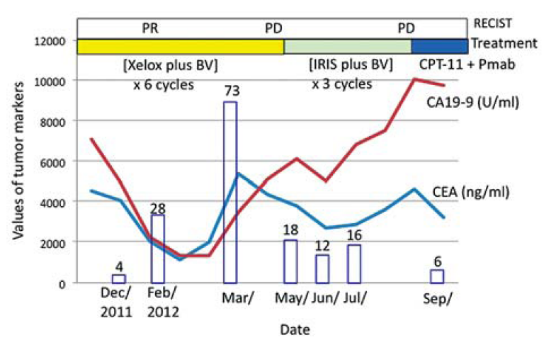
- CTC作为CRC化疗结果的预测生物标志物,化疗前后CTC数量的比较可预测治疗结果。治疗后存在的数量变化可能比用现有方法更早地预测治疗结果。
Otsuka K, Imai H, et al. Practical utility of circulating tumour cells as biomarkers in cancer chemotherapy for advanced colorectal cancer. Anticancer Res. 2013 Feb;33(2):625-9.
(6)CTC检测是评估和预测局部晚期直肠癌(LARC)患者新辅助放化疗(CRT)反应的有力且有前途的工具

Figure 1: Relationship between CTC counts and tumor regression response. A. Changes of CTC counts between pre-CRT and post-CRT in TRG 0-2 (N=51) and TRG3-4 (N=64). B. Changes of CTC counts between pre-CRT and post-CRT in pCR (N=25) and non-pCR group (N=90)
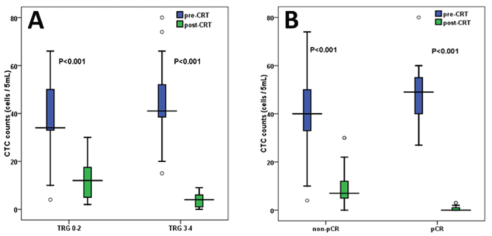
Figure 2: Receiver operating characteristic (ROC) curve analysis for Δ%CTC. A. Receiver operating characteristic (ROC) curve analysis for Δ%CTC in discriminating responders (TRG 3-4) from non-responders (TRG 0-2). B. Receiver operating characteristic (ROC) curve analysis for Δ%CTC in discriminating pCR from non-pCR patients
- 115名T3-4和/或N +直肠癌的患者。所有患者均接受新辅助CRT,6-8周后接受根治性手术。根据肿瘤消退等级(TRG)分类评估手术后的病理结果。
- 基于TRG评分,患者被分类为应答者(TRG3-4)和无应答者(TRG0-2)。应答者的基线CTC计数显着高于无应答者(44.50±11.94对37.67±15.45,P = 0.012)。
- 应答者的CRT后CTC计数显着低于无应答者(3.61±2.90对12.08±7.40,P <0.001)
- CTC检测是评估和预测LARC患者新辅助CRT反应的有力且有前途的工具。
Sun W, Li G, et al. Circulating tumor cells: A promising marker of predicting tumor response in rectal cancer patients receiving neoadjuvant chemo-radiation therapy. Oncotarget. 2016 Oct 25;7(43):69507-69517