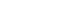【学术前沿】CTC HER2对晚期乳腺癌HER2阴性患者的预后价值
近年来,靶向治疗广泛应用于乳腺癌治疗中。曲妥珠单抗和其他几种抗HER2药物被批准用于治疗HER2阳性(tHER2+)的乳腺癌患者,患者预后已经得到改善。
HER2阴性肿瘤(tHER2-)患者通常不接受抗HER2药物。然而,由于乳腺癌是一种异质性疾病,一部分tHER2-乳腺癌患者的循环肿瘤细胞中有可能含有HER2阳性细胞,因此有关这些患者是否可以从抗HER2靶向治疗中获益的争论一直存在。目前普遍使用组织活检确定tHER2状态,以指导抗HER2靶向治疗的使用。而组织活检是侵入性的,通常只有通过手术获取样本,而肿瘤细胞的蛋白表达或分子表征是呈现动态变化的, 为了及时准确地检测到这些变化并随之调整治疗方案,需要重复进行肿瘤活检。因此,需要新的非侵入性策略来实时确定HER2的状态,以更有效地指导抗HER2靶向治疗的使用。最近,一项最新的研究通过分析cHER2状态与乳腺癌患者生存状况的关系,验证了CTC HER2对于晚期乳腺癌HER2阴性患者的预后价值。以下是重要研究结果。

研究目的
探究肿瘤组织中HER2表达(tHER2)与循环肿瘤细胞中HER2状态(cHER2)的差异性,以及tHER2阴性/cHER2阳性表达的患者是否能从抗HER2靶向治疗中获益。
研究方法
对105例晚期tHER2阴性乳腺肿瘤患者进行CTC HER2检测。采用单变量Cox模型和多变量Cox模型分析cHER2状态与无进展生存(PFS)的相关性,采用Kaplan-Meier法比较患者生存情况的差异。
重要研究结果
1. cHER2状态与患者PFS的关系
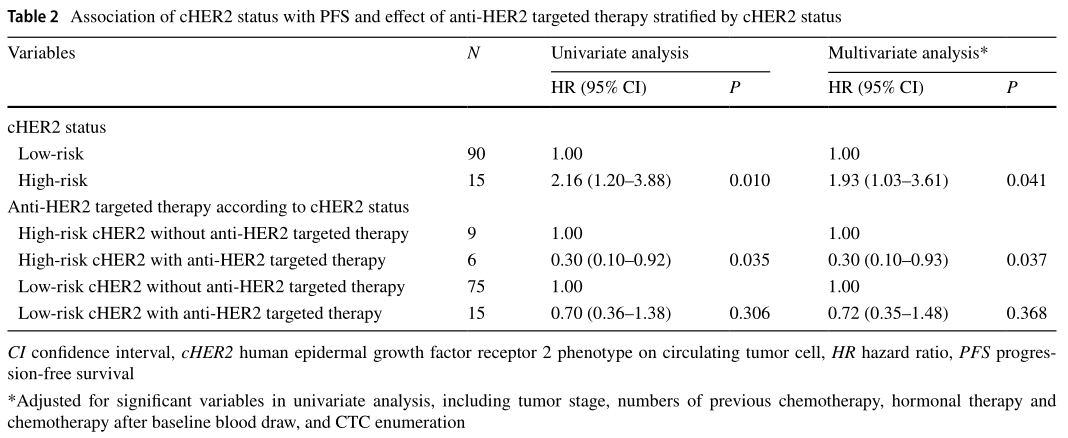
在中位随访87.8周期间,83例患者出现疾病进展。正如预期,CTCs升高(≥5)的患者疾病进展的风险增加。当检测到cHER2+时,观察到较差的存活率。与低风险cHER2患者相比,高风险cHER2患者的PFS明显较差,HR为2.16 (95% CI 1.20-3.88, P=0.010),生存期较短(4.6周vs 20.0周,log-rank P=0.008)。在低风险的cHER2患者中,有CTC和没有CTC的患者生存期相似(18.3周vs. 20.7周; P=0.419)。
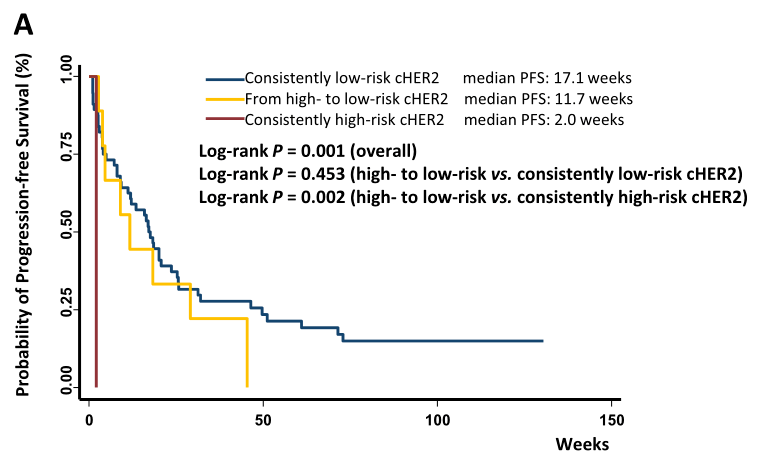
2. 基于cHER2状态的PFS抗HER2靶向治疗的效果
tHER2阳性的肿瘤患者通常接受抗HER2靶向治疗。为了研究tHER2阴性而cHER2阳性的患者是否能从抗HER2靶向治疗中获益,研究小组将患者分为四组,包括:
(1)低风险cHER2患者,已接受抗HER2靶向治疗;
(2)低风险cHER2患者,未接受HER2抗靶向治疗;
(3)高风险cHER2患者,已接受抗HER2靶向治疗;
(4)高危人群cHER2,未接受抗HER2靶向治疗。
在高风险cHER2患者中, 相比于那些没有接受抗HER2靶向治疗的患者,接受过抗HER2靶向治疗后PFS有显著改善 。
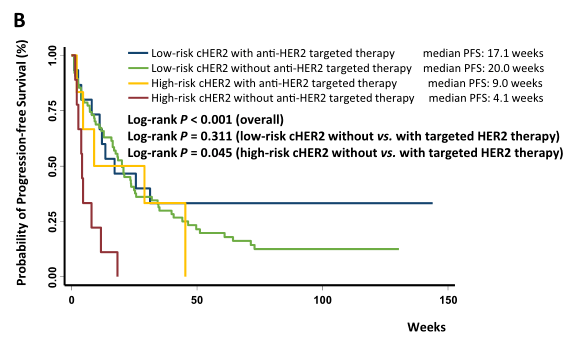
在低风险的cHER2患者中,接受或未接受抗HER2靶向治疗的患者生存期相似。当分析中排除掉没检测出CTC的患者时,结果与此相似。
在调整协变量后,与低风险组相比,高风险组的进展风险(HR = 1.93, 95% CI1.03-3.61)继续增加。多变量分析与单变量分析结果相似,再次表明高风险cHER2患者接受抗HER2靶向治疗后进展风险显著降低。
3.cHER2状态和患者生存的变化
研究组进一步评估了至少有一次随访的患者中cHER2状态改变的预后价值。在本研究纳入的105例患者中,分析了67例首次随访时的cHER2状态(从基线到首次随访抽血的中位时间:11.0周,四分位数范围:7.0-15.9周)。根据患者基线和首次随访时的cHER2状态将67例患者分为4组,包括:
(1)基线和首次随访时低风险的cHER2;
(2)基线低风险,首次随访高风险;
(3)基线时高危,首次随访时低风险;
(4)基线和首次随访时高危。
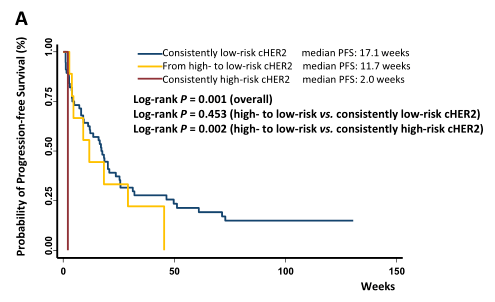
第1组中位PFS为17.1周,第4组中位PFS为2.0周,值得注意的是,与第4组(log-rank P = 0.002)相比,第3组患者的cHER2在第一次随访时从高危变为低危,生存期(PFS中位数为11.7周)较高,但仍略低于第1组(log-rank P = 0.453,图3a)
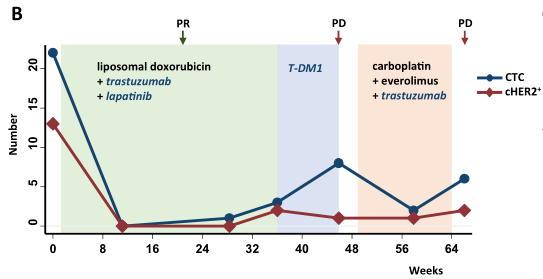
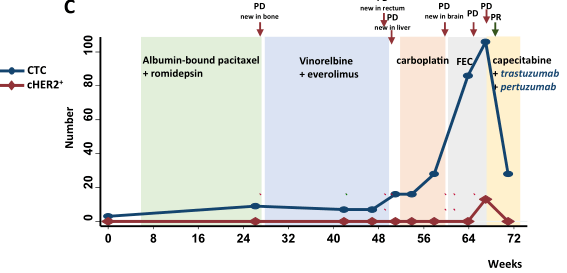
随后,通过从患者采集的连续血液样本,评估cHER2状态的动态变化与患者生存率的关系。下图描绘了一个转移性HR+/HER2-(管腔型,图b)及一个转移性HR-/HER2-(三阴性,图c)肿瘤患者多次隨訪时的CTC和cHER2+数量与疾病进展的关系。管腔型乳腺癌患者在基线时有22个CTC,其中13个显示cHER2+。在联合化疗(阿霉素脂质体)和抗HER2靶向治疗(曲妥珠单抗和拉帕替尼)开始后,CTC值降至零,随后的影像学检查显示骨转移明显改善,表明对治疗有部分反应。然而,患者随后发展为进行性疾病,CTC计数也逐渐升高,cHER2+再次出现(3个CTC中有2个HER2阳性)。在更改了化疗方案并联合抗HER2药物的靶向治疗后,CTC数量开始减少,但CTC上HER2的表达保持阳性,病情进一步发展,表明治疗耐药。三阴性乳腺癌(TNBC)患者在基线时有3个CTC,没有一个是cHER2+。随着患者多线化疗的失败,在多个器官发现新的转移灶, CTC数量也持续增加。在治疗开始后第67周,检测到106颗CTC,其中13颗CTC又出现HER2阳性。在CTC急剧增加之后,患者接受了化疗(卡培他滨)及抗HER2靶向治疗(曲妥珠单抗和pertuzumab)的联合治疗。两周后影像学检查显示患者对联合治疗有反应,CTC和cHER2+均明显下降。
结论
肿瘤的进展是一个复杂的过程,肿瘤标志物有高度动态的变化。与组织活检相比,CTC是一种有效的替代方法,可用于对重要肿瘤标志物(如HER2状态)进行实时的动态监测和评估。在tHER2-肿瘤晚期乳腺癌患者中,cHER2状态有可能指导高危cHER2患者应用抗HER2靶向治疗。
华得森生物专注于液体活检技术研发和应用转化,基于CytoSorter®CTC一体化检测系统,已完成CTC计数与分子分析联合技术开发平台的布局和搭建,针对临床及科研的实际需求,提供CTC检测与分子分析一体化解决方案。
华得森®CTC提供乳腺癌无创精准检测整体方案
参考文献:
Chun Wang et al.Prognostic value of HER2 status on circulating tumor cells
in advanced‑stage breast cancer patients with HER2‑negative tumors.Breast Cancer Research and Treatment.2020 Jun;181(3):679-689.